Komplexný zdroj určený pacientom, ktorým bol predpísaný liek IDACIO®▼ (adalimumab) a ich lekárom a zdravotníkom, ktorých cieľom je podpora pacientov počas ich ochorenia
Pri registrácii do programu si tiež môžete prezrieť nástroje a zdroje, ktoré sú vašim pacientom k dispozícii
Kliknite sem a zaregistrujte sa pre získanie úplného prístupu na webové stránky.
Táto registrácia je určená len pre lekárov, ktorí liečia pacientov liekom IDACIO®.
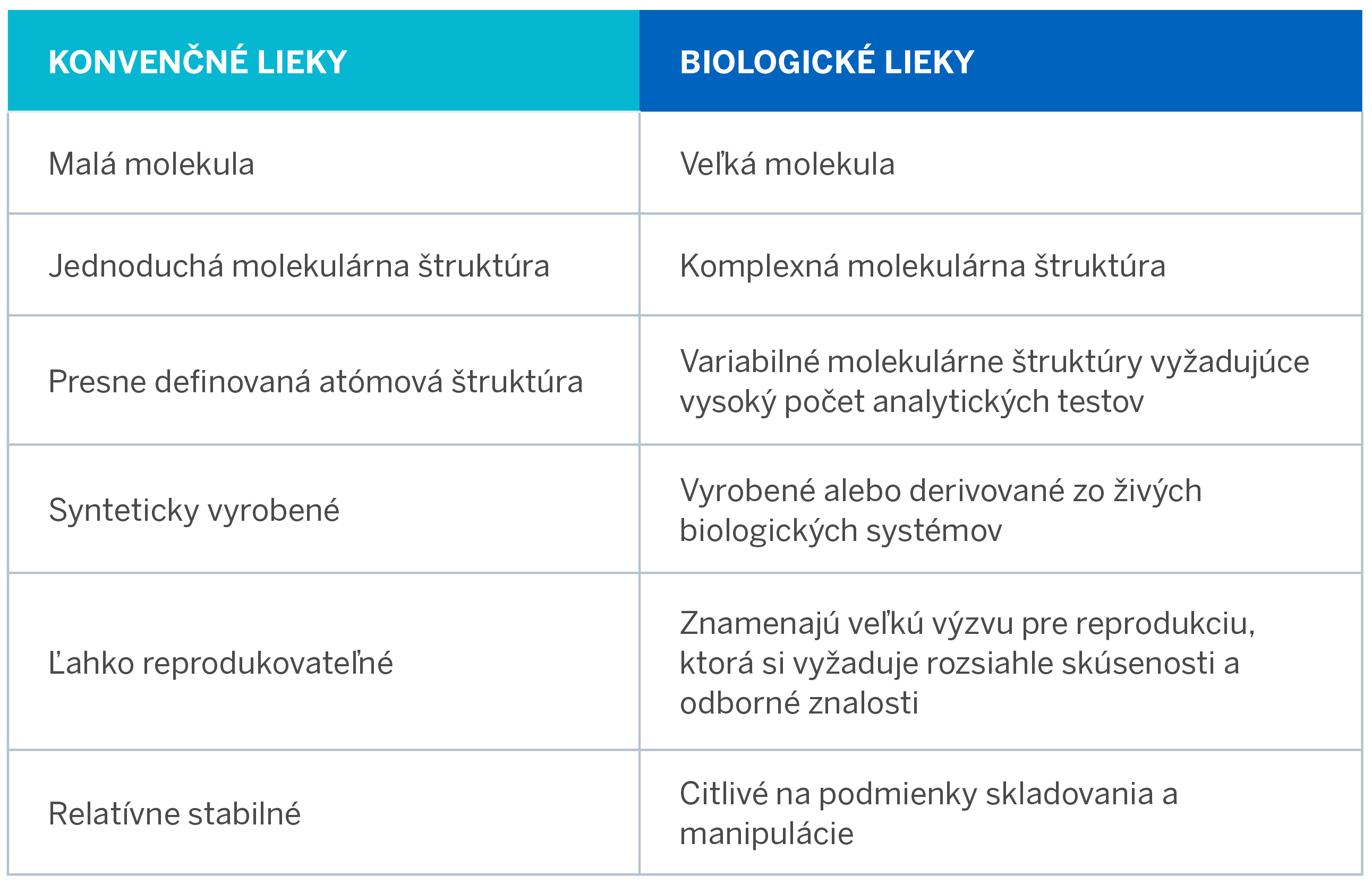
Biologické lieky spôsobili revolúciu v liečbe mnohých chronických a život ohrozujúcich ochorení.1 Biologické lieky sú definované ako komplexné molekulárne proteíny, ktoré sú vytvorené alebo derivované zo živých biologických systémov, a ktoré využívajú najmodernejšie rekombinantné biotechnologické postupy.1
Tabuľka uvedená vedľa: zhŕňa rozdiely medzi konvenčnými a biologickými liekmi (napr. adalimumabom).1,2,3
Európska lieková agentúra definuje biosimilárny liek ako „liek veľmi podobný inému biologickému lieku, ktorý je schválený v EÚ (tzv. „referenčný liek“)."4 Biosimilárne lieky nie sú generické lieky.4 Generický liek je identický alebo biologicky rovnocenný s referenčným liekom vo všetkých aspektoch, pretože je vytváraný chemickou syntézou.4 Biosimilárny liek je veľmi podobný, nie totožný s referenčným liekom, pretože je produkovaný v živých bunkách.4 V porovnaní s referečným liekom však nesmú existovať žiadne klinicky významné rozdiely o účinnosti alebo bezpečnosti.4
Po vypršaní patentovej ochrany môžu farmaceutické spoločnosti vyvíjať a uvádzať biosimilárne lieky na trh.4 Biosimilárne lieky, ktoré preukázali rovnocennú klinickú účinnosť a podobný bezpečnostný profil ako referenčné lieky sú stále viac využívané systémami zdravotnej starostlivosti, pretože ponúkajú úsporu nákladov a zvýšenie dostupnosti najmodernejšej terapie väčšiemu počtu pacientov.4
Biosimilárne lieky prechádzajú prísnymi testami, pri ktorých musia preukázať, že sú podobné referenčnému lieku. Ide o tri typy štúdií:4
Porovnávacia štúdia kvality: Tieto in vitro štúdie porovnávajú štruktúru proteínov a biologickú funkciu medzi biosimilárnym a referenčným liekom.
Porovnávacie predklinické štúdie: zahŕňajú farmakodynamické štúdie (zvyčajne in vitro) na účely porovnania biosimilárneho a referenčného lieku. V niektorých prípadoch sú vyžadované in-vivo toxikologické štúdie.
Porovnávacie klinické štúdie: Klinické štúdie sú určené na potvrdenie biologickej podobnosti a zahŕňajú štúdie zamerané na toxikológiu, farmakokinetiku a farmakodynamiku u zdravých dobrovoľníkov a účinnosť aspoň v jednej indikácii, pre ktorú je referenčný liek schválený. Nasledujú štúdie na preukázanie podobnej účinnosti, bezpečnosti a imunogenicity.
Regulačné pokyny pre schvaľovanie biosimilárnych liekov umožňujú extrapoláciu indikácií.4 To znamená, že všetky dostupné údaje o biosimilárnom a referenčnom lieku v jednej indikácii môžu byť použité na získanie schválenia pre použitie biosimilárnych liekov v iných indikáciách referenčného lieku.4
Bezpečnosť je pre schválenie nového biosimilárneho lieku rozhodujúca. Nesmie preukazovať žiadne klinicky významné rozdiely v imunitnej odpovedi v porovnaní s referenčným liekom. Imunitné reakcie môžu ovplyvniť ako bezpečnosť, tak účinnosť lieku. V niektorých prípadoch môže byť potrebné vykonať osobitné štúdie zamerané na sledovanie imunogenicity.
Biosimilárne lieky sú schválené ako vysoko podobné biologickému referenčnému lieku s tým, že medzi nimi nesmú byť klinicky významné rozdiely. V dôsledku toho môže byť pacient pod vedením lekára a pri starostlivom sledovaní prevedený z referenčného lieku na biosimilárny liek. Pribúdajú klinické dôkazy, že prechod z referenčného lieku na biosimilárny liek nemá vplyv na účinnosť a bezpečnosť liečby.
Úplný obsah webových stránok získate kliknutím sem. Ten je k dispozícii len pre zdravotníckych pracovnikov, ktorí liečia pacientov liekom IDACIO®.
1. Abraham J. Developing oncology biosimilars: An essential approach for the future. Semin Oncol 2013;40(Suppl1):S5-S24
2. Kozlowski S, Woodcock J, Midthun K, Sherman RB. Developing the Nation’s Biosimilar Program. N Engl J Med 2011;365:385-388
3. European Generics Medicines Association (EGA) Biosimilar Medicines Handbook. 2016 [online], dostupné na: [http://www.medicinesforeurope.com/wp-content/uploads/2016/04/BIOSIMILAR-MEDICINES-HANDBOOK_INT_web_links2.pdf] [Platné od marca 2020]
4. Biosimilars in the EU. Information guide for healthcare professionals. European Medicines Agency, dostupné na: [https://www.ema.europa.eu/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_en.pdf] [Platné od marca 2020]
5. Cohen HP, Blauvelt A, Rifkin RM, Danese S, Gokhale SB, Woollett G. Switching reference medicines to biosimilars: A systematic literature review of clinical outcomes. Drugs. 2018 Mar;78(4):463-478.
Po registrácii použite nižšie uvedené pole pre prihlásenie.
Práve opúšťate stránku KabiCare, radi by sme vás upozornili, že nemáme žiadne spojenie ani kontrolu nad obsahom dostupným na externých weboch tretích strán.
Pokračovať